次世代電池レースで脚光を浴び始めた「マグネシウム電池」(1)
2010年3月26日
(これまでの 山路達也の「エコ技術者に訊く」はこちら)

マグネシウム空気電池の試作品。シートにスポイトで水を垂らし、電極に小さなプロペラを付けると、取材中の数時間、プロペラはずっと回り続けた。写真の電池の場合、数日間にもわたって放電し続けられるという。
電池材料として理想的なマグネシウム
──マグネシウム電池を開発されているそうですね。どのようなタイプの電池なのでしょうか?
栗原:株式会社TSCが開発しているのは一次電池(充電できない電池)で、これが2種類。NEDOのプロジェクトの一環として、埼玉県産業技術総合センター(SAITEC)が開発しているのは二次電池(充電可能な電池)です。
──なぜ、マグネシウムなのですか?
栗原:電池の能力は、酸化還元反応によって決まります。簡単にいうと、金属のイオン化傾向に大きく左右されます。イオン化傾向の強い順に金属元素を並べると、リチウム(Li)、カリウム(K)、カルシウム(Ca)、ナトリウム(Na)、マグネシウム(Mg)、アルミニウム(Al)、亜鉛(Zn)、鉄(Fe)、ニッケル(Ni)……となります。
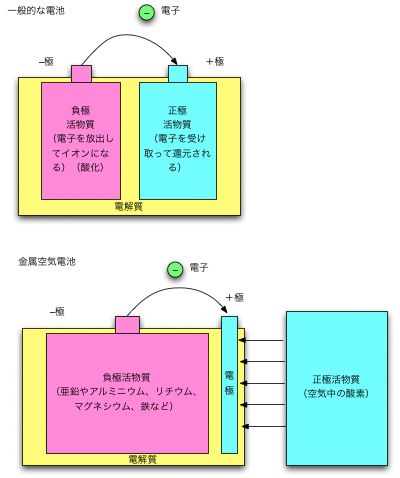
一般的な電池と、金属空気電池の仕組み。
今、リチウムが注目されているのも、このイオン化傾向によるわけです。リチウムを使えば最高の電池が作れると多くの人は考えていますが、リチウムの確認埋蔵量は1100万トン程度と少なく、偏在性が高いという欠点があります。また、水と激しく反応するので、電解液に水を使用することができません。
電解液に水を使える金属元素の中では、マグネシウムが最もイオン化傾向が強く、優秀な電池となる可能性を持っています。さらに、マグネシウムの資源量は豊富で、地中にも海中にも無尽蔵といえるほど存在します。
──中学校の理科実験用として、マグネシウム空気電池の作り方を解説している記事を見たことがあります。資源が豊富でこんなに簡単に作れるのに、マグネシウムを使った実用電池が今までなかったのはなぜでしょう?
栗原:実験用のマグネシウム空気電池で使われている反応は、電気化学の教科書にも載っているもので、昔からよく知られていました。TSCの一次電池の1つもこの反応を利用しています。
まず、一般的な電池の構造を簡単に説明しておきましょう。負極にはイオン化しやすい負極活物質が、正極には還元されやすい正極活物質が入っています。負極活物質が電子を放出して酸化され、正極活物質はその電子を受け取って還元される。そして同時に、電解液の中をイオンが移動して電気的バランスがとられることで、連続して反応がおこり、電気を取り出せるのです。
マグネシウム空気電池では、負極活物質は金属マグネシウム、正極活物質は空気中の酸素です。負極のマグネシウムは、電子を放出してマグネシウムイオンとなり、電解液の中に溶け出します。一方、正極では酸素と水が電子を受け取り、水酸化イオンとなります。全体で見ると、マグネシウムと酸素、水から水酸化マグネシウム(Mg(OH)₂)が生成されます。水がなくなると、水酸化マグネシウムは最終的に酸化マグネシウム(MgO)になります。

──何が問題だったのでしょう?
栗原:通常、電池は自己放電を防ぐため、電解液をアルカリ性にします。自己放電とは、負極の金属が溶解すると同時に、発生した電子と水素イオンが反応して水素が生成し、このため電子が正極に移動せず電流が流れない現象です。この自己放電は水素イオン濃度が高い酸性溶液で顕著に起こります。
しかし、アルカリ電解液の中では、マグネシウムの表面に電気もイオンも通さない被膜ができて、すぐ電気が流れなくなってしまうのです。この反応では熱も発生していました。さまざまな研究者が被膜と発熱の問題を解決しようとしましたが、誰も成功していません。実用電池にマグネシウムを使うことは不可能だ、そう誰もが考えていました。
山路達也の「エコ技術研究者に訊く」
過去の記事
- 超低消費電力を実現できるか? 「板バネ」ナノマシンコンピュータ(3)2011年3月24日
- 超低消費電力を実現できるか? 「板バネ」ナノマシンコンピュータ(2)2011年3月24日
- 超低消費電力を実現できるか? 「板バネ」ナノマシンコンピュータ(1)2011年3月24日
- オーランチオキトリウムが、日本を産油国にする(4)2011年2月25日
- オーランチオキトリウムが、日本を産油国にする(3)2011年2月25日

